Seit wenigen Jahren sind neue Abstrichsysteme für die so genannte liquid based microbiology (LBM) verfügbar.
Gegenüber den früher verwendeten trockenen Abstrichen haben diese eSwab® Abstriche den Vorteil, dass die beim Abstreichen aufgenommenen Erreger gleichmäßig in einer schützenden Nährlösung aufgenommen werden. Dies erlaubt im Labor einen gleichmäßigen Auftrag des Untersuchungsmaterials auf alle verwendeten Nährböden, während sich beim Ausstreichen trockener Abstriche ein Verdünnungseffekt einstellt: der erste Nährboden wird mit einer großen Menge abgestrichener Erreger versehen, die folgenden Nährböden erhalten immer weniger Erregermaterial.
Das eingesetzte Transportmedium der eSwab® Abstriche ermöglicht darüber hinaus auch ein längeres Überleben der Erreger während des Probentransports und gewährleistet dadurch eine höhere Nachweisrate auch bei umweltlabilen Erregern.
PCR-Untersuchungen (respiratorische Viren, Chlamydien, HSV, VZV ) sind ebenfalls aus eSwab® Abstrichen problemlos möglich.
Wir empfehlen daher für sämtliche Abstrichuntersuchungen ausschließlich die Verwendung von eSwabs® Abstrichen.
 Copan eSwab®
Copan eSwab®
Standardabstrich für mikrobiologische Untersuchungen (Haut- und oberflächliche Abstriche, Nasen-/ Rachenabstriche (E+R), MRSA-Abstriche, Wundabstriche) KEIN Liquor, Gewebe, Stuhl!
 Copan eSwab® Urethra
Copan eSwab® Urethra
Urethralabstrich
Benutzung von eSwab® beflockten Abstrichen
cave: lipophiles Gel zieht lipoide Substanzen (z.B. Amiodaron) an
►falsch niedrige Medikamentenspiegel

z.B. für Blutgruppen
Für die Gerinnungsdiagnostik
Füllmenge beachten, sonst falsche Ergebnisse!!
Nach Entnahme schwenken!
Füllmenge beachten!! Nach Entnahme schwenken!
Auch für Punktate (z.B. Synovialanalyse) und PCR- Untersuchungen geeignet
Für Glukosebestimmung
Glukolysehemmung, auch für Fruktose im Sperma geeignet
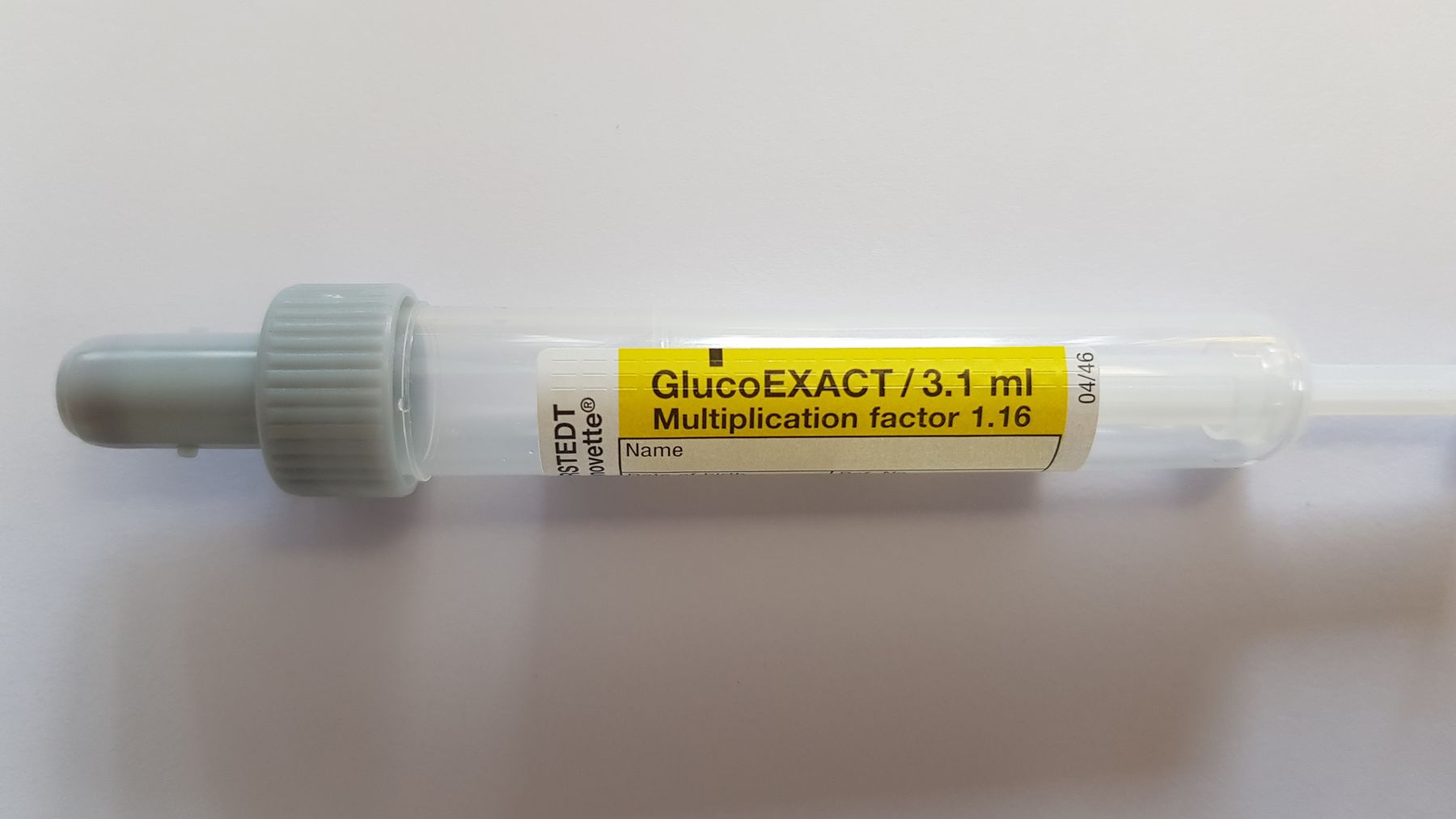
Für Glukosebestimmung während der SCHWANGERSCHAFT
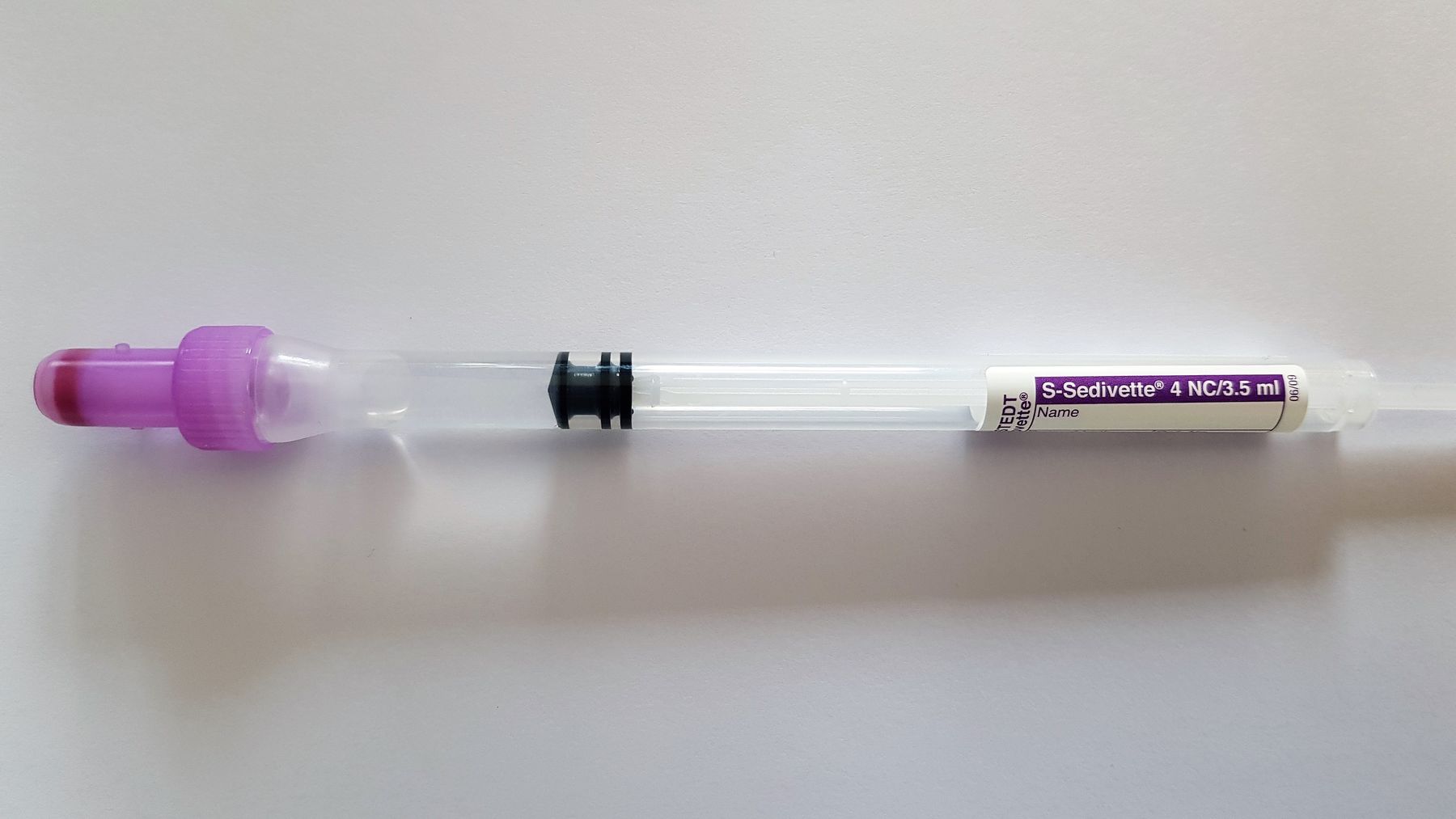
Füllmenge beachten, sonst falsche Ergebnisse!!
Nach Entnahme schwenken!

EliSpot Borrelia; bevorzugte Monovette für den Postversand bei Untersuchungen zur T-Zell-Stimulation
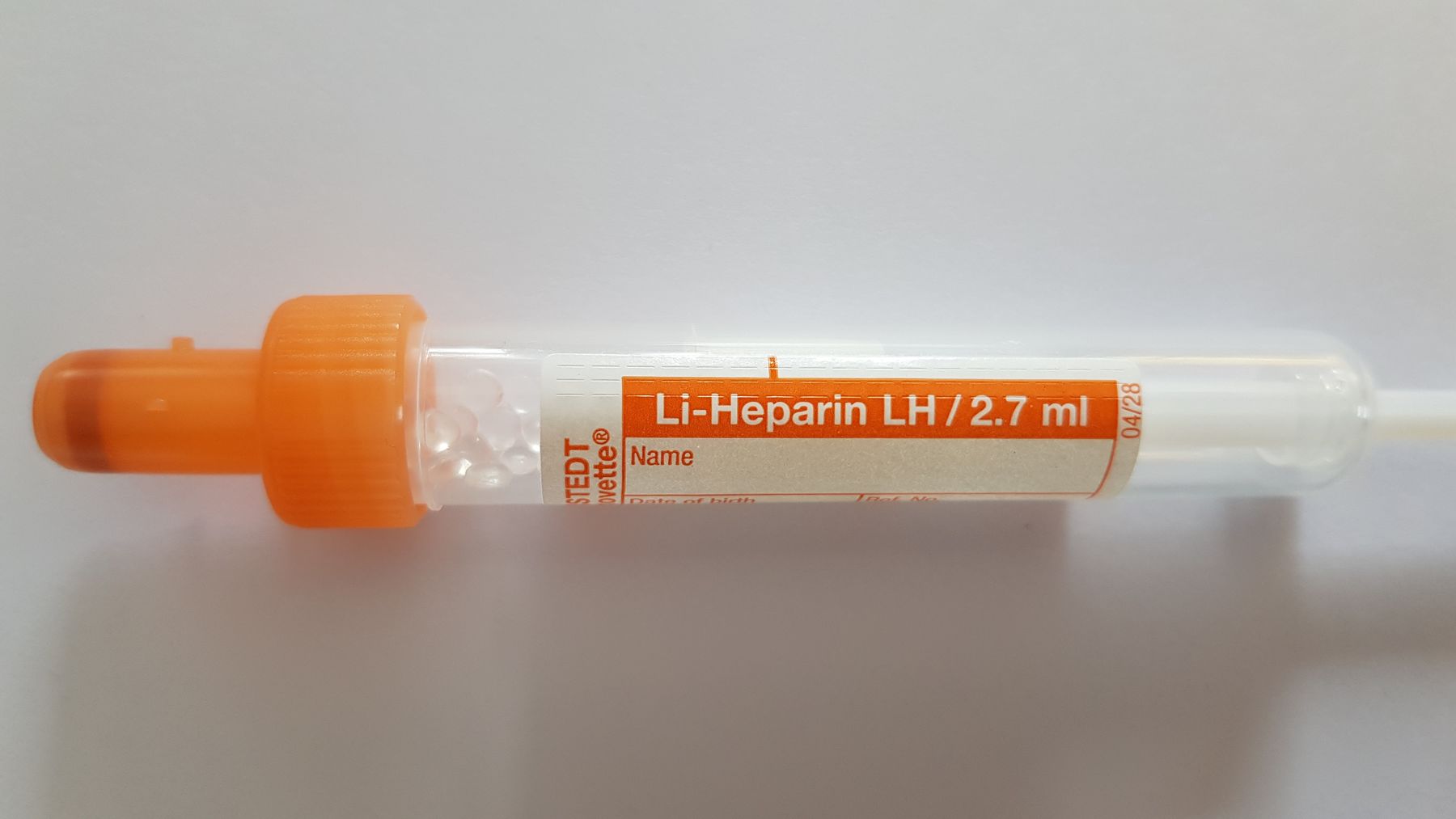
z.B. Spurenelementanalysen, Punktate für klinisch-chemische Untersuchungen
Alternativ: EliSpot Borrelia wenn keine CPDA-Monovette vorrätig
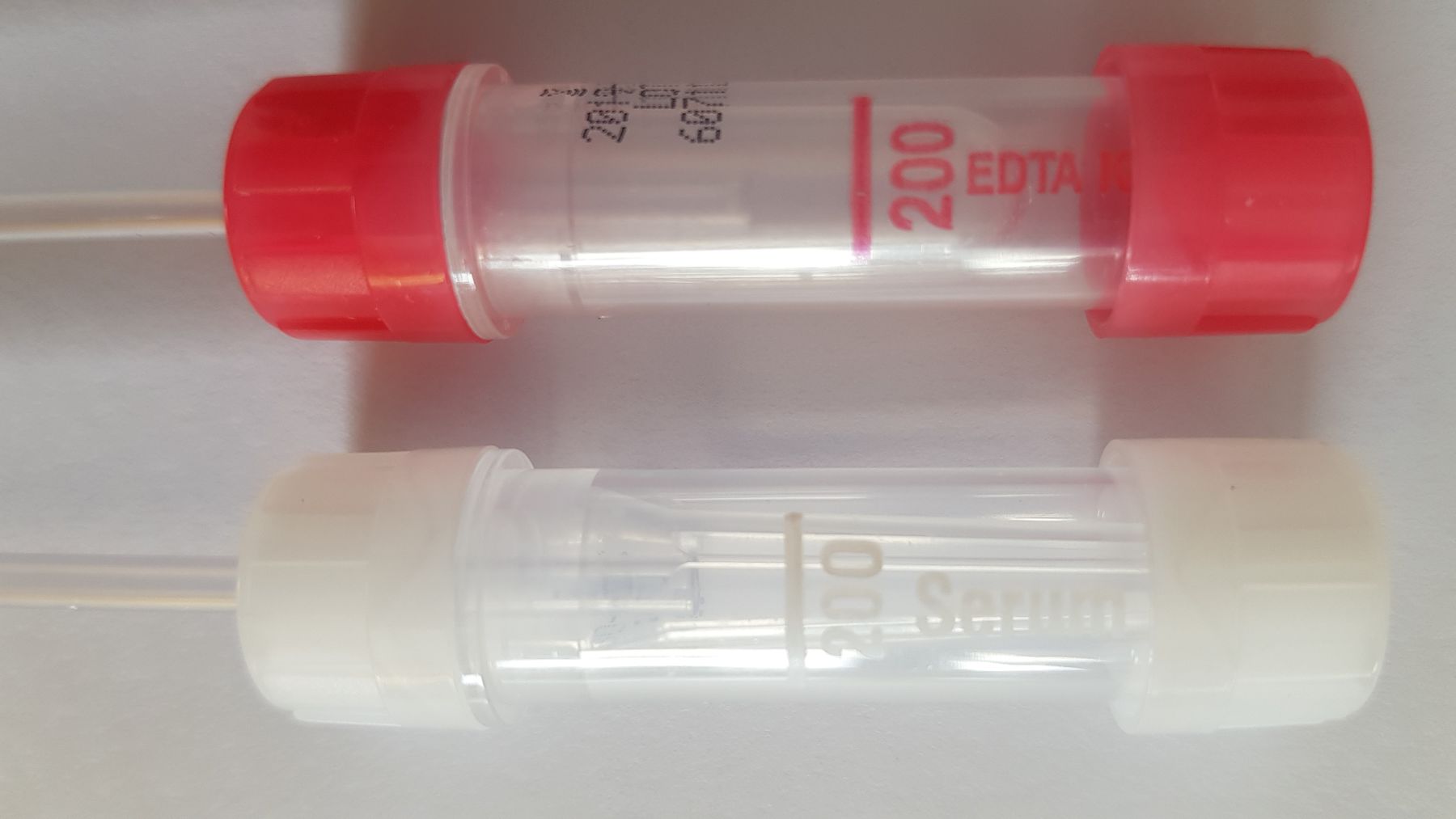
z.B. bei Kindern, Kapillarblut
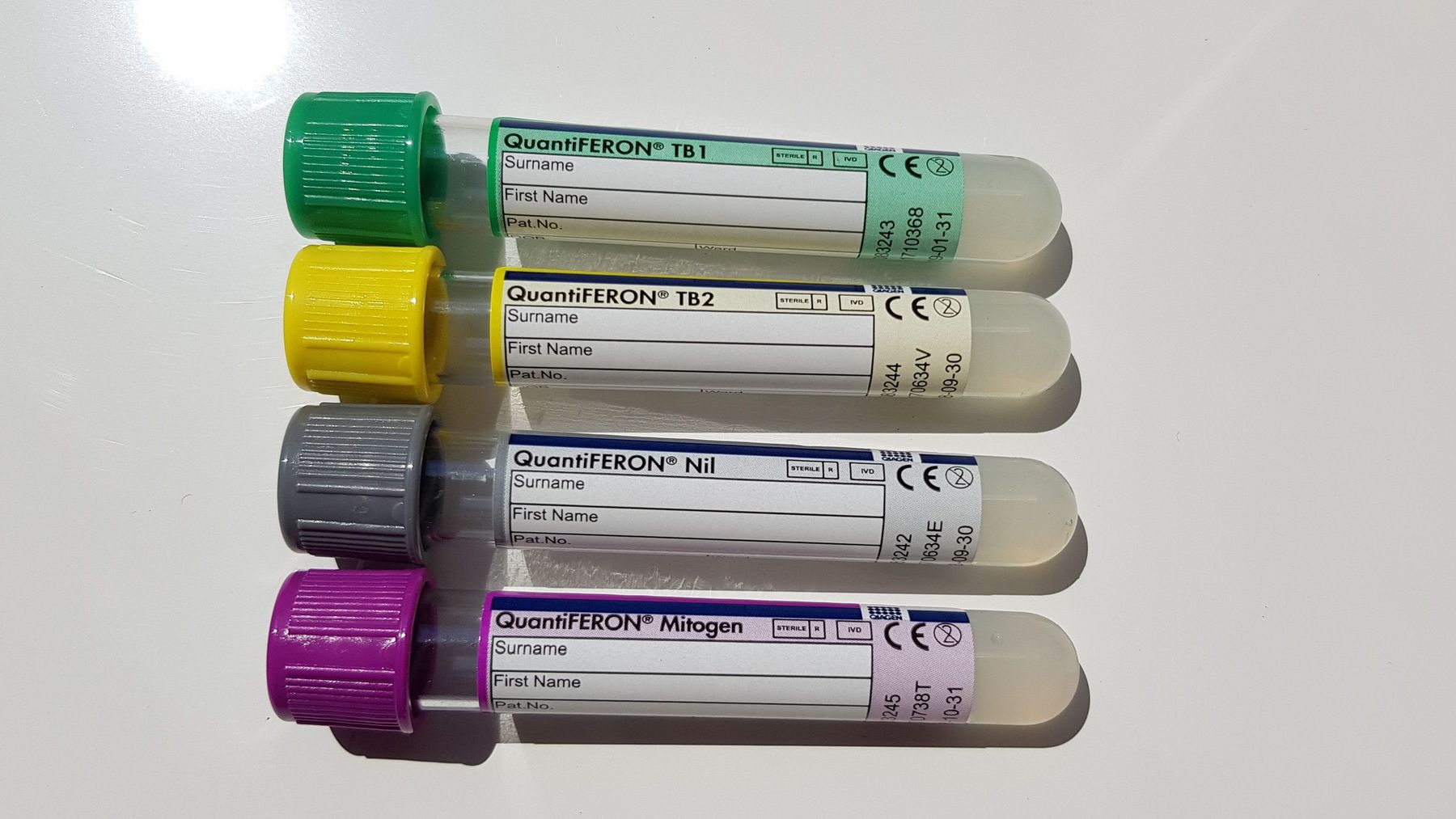
15x schwenken, nicht schütteln!
Nicht geeignet zum Tuberkulose-Direkt-Nachweis!

Lagerung und Transport
Unverzüglicher Transport in das Labor (innerhalb 4h).
Beimpfte Blutkulturen vor dem Transport bei Raumtemperatur lagern, nicht im Kühlschrank!!!
Probennahme
Aus der Praxis: Die Verwendung von Becton Dickinson (BD) Blutkulturflaschen ermöglicht in Verbindung mit dem neuartigen MALDI-TOF System für die schnelle Erregeridentifizierung einen Direktnachweis von Erregern aus der positiv gemeldeten Blutkultur. Damit liegen relevante Befunde häufig einen Tag schneller vor als mit der traditionellen Mikrobiologie!
Serum vom gleichen Tag für AK-Indices und oligoklonale Banden einsenden!
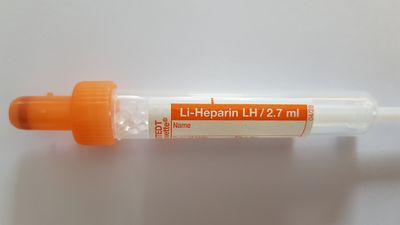
Bei PCR-Untersuchungen können Li-Heparin Monovetten NICHT verwendet werden! Bitte verwenden Sie stattdessen EDTA- oder Citrat-Monovetten.
(Auch für Trachealsekret und Bronchiallavage verwendbar).
Gewinnung am besten morgens nach Spülung des Mundraums mit Leitungswasser (außer bei Verdacht auf TB) ggf. Ultraschallvernebler mit 3%, steriler Kochsalzlösung zur Provokation einsetzen

Aspiration, nativ in sterile Röhrchen, erstes Aspirat verwerfen

Optimales Gefäß für intraoperativ gewonnenes Gewebe (z.B. Herzklappen)
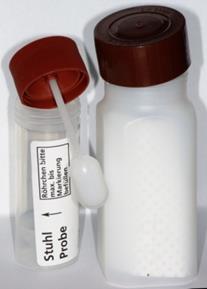
Empfohlen an 3 aufeinander folgenden Tagen.
Verwenden für:
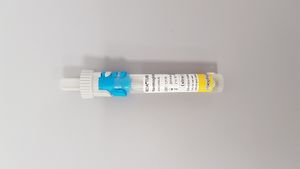
Für Nachweis von Hämoglobin im Stuhl

Bei Verdacht auf Madenwürmer (Enterobius vermicularis, Oxyuris oxyura) Analklebestreifen auf Objektträger einsenden

Für Eiweiß im Urin
Abgefüllter Sammelurin auf Katecholamine, HIES, Disk-Elektrophorese, Drogenscreening. Kühl lagern und möglichst schnell transportieren!
Für Chlamydia trachomatis- und Gonokokken-PCR

Wenn kein rascher Transport ins Labor möglich für Urinkulturen (verhindert die Vermehrung von Bakterien, ohne sie abzutöten); für PCR-Untersuchungen NICHT geeignet.

Bei Verdacht auf Urogenital-Tbc: mind. 20 ml Morgenurin (abends zuvor wenig trinken)
 +
+ 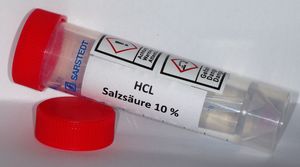
Für klinisch-chemische Untersuchungen, bspw. Dopamin, Katecholamine, Vanillinmandelsäure, Homovanillinsäure oder 5-Hydroxyindolessigsäure.

Versandbehälter können im Labor angefordert werden!

Probengefäß 7/8 befüllen, Probenahme gemäß Probenahme-SOP bzw. gemäß Probenehmerschulung
Bei der Entfernung der Zecke bitte darauf achten, dass der Zeckenleib nicht gequetscht wird. Es könnten dadurch eventuelle Erreger aus der Speicheldrüse der Zecke in die Wunde gepresst werden.
Die entfernte bitte Zecke möglichst intakt und in einem kleinen Gefäß oder kleinem Plastikbeutel einschicken. Bitte auf sicheren Verschluss der Behältnisses achten! Wir stellen Ihnen auch gerne kostenlos ein Gefäß zur Verfügung.
Die Zecke bitte auf keinen Fall mit Tesa Film ankleben!
